Contribution du système nerveux autonome dans la compréhension de l´association de l´hypotension orthostatique et l´hypertension artérielle du décubitus dorsal chez le diabétique: à propos d´un cas et une revue de littérature
Safae Harrak, Mustapha El Bakkali, Jihad Raoui, Souad Aboudrar, Halima Benjelloun
Corresponding author: Safae Harrak, Service de Cardiologie A, Centre Hospitalier Universitaire (CHU) Ibn Sina-Rabat, Rabat, Maroc 
Received: 09 Nov 2019 - Accepted: 26 Feb 2020 - Published: 15 Mar 2020
Domain: Cardiology
Keywords: Neuropathie autonome cardiaque, diabéte, hypotension orthostatique, Hypertension artérielle de décubitus dorsal
©Safae Harrak et al. PAMJ Clinical Medicine (ISSN: 2707-2797). This is an Open Access article distributed under the terms of the Creative Commons Attribution International 4.0 License (https://creativecommons.org/licenses/by/4.0/), which permits unrestricted use, distribution, and reproduction in any medium, provided the original work is properly cited.
Cite this article: Safae Harrak et al. Contribution du système nerveux autonome dans la compréhension de l´association de l´hypotension orthostatique et l´hypertension artérielle du décubitus dorsal chez le diabétique: à propos d´un cas et une revue de littérature. PAMJ Clinical Medicine. 2020;2:110. [doi: 10.11604/pamj-cm.2020.2.110.20928]
Available online at: https://www.clinical-medicine.panafrican-med-journal.com//content/article/2/110/full
Case report 
Contribution du système nerveux autonome dans la compréhension de l´association de l´hypotension orthostatique et l´hypertension artérielle du décubitus dorsal chez le diabétique: à propos d´un cas et une revue de littérature
Contribution du système nerveux autonome dans la compréhension de l´association de l´hypotension orthostatique et l´hypertension artérielle du décubitus dorsal chez le diabétique: à propos d´un cas et une revue de littérature
Contribution of the autonomic nervous system to the understanding of the association between orthostatic hypotension and supine hypertension in diabetics: about a case and literature review
Safae Harrak1,&, Mustapha El Bakkali2, Jihad Raoui1, Souad Aboudrar2, Halima Benjelloun1
1Service de Cardiologie A, Centre Hospitalier Universitaire (CHU) Ibn Sina-Rabat, Rabat, Maroc, 2Equipe de Physiologie de l´Exercice et du Système Nerveux Autonome (EPE-SNA), Faculté de Médecine et de Pharmacie, Université Mohammed V de Rabat, Rabat, Maroc
&Auteur correspondant
Safae Harrak, Service de Cardiologie A, Centre Hospitalier Universitaire (CHU) Ibn Sina-Rabat, Rabat, Maroc
La neuropathie autonomique cardiaque (NAC) est parmi les principales dysautonomies chez les diabétiques. Elle aggrave le pronostic des diabétiques et prédispose à un haut niveau de mortalité. L´hypotension orthostatique constitue le signe clinique le plus frappant de la NAC. Chez certains patients, elle peut coexister avec l´hypertension artérielle (HTA) du décubitus dorsal. Cette association pose un problème thérapeutique. Notre objectif est d´essayer de comprendre, en illustrant par un cas clinique, les mécanismes physiopathologiques de cette association afin de proposer une prise en charge thérapeutique pour ces patients.
Cardiovascular autonomic neuropathy (CAN) is one of the main dysautonomias in diabetics. It worsens prognosis of diabetes predisposing patients to an increased risk of mortality. Orthostatic hypotension is the most striking clinical sign of CAN. In some patients, it can coexist with supine hypertension. This association poses a therapeutic problem. The purpose of our case study was to understand, the pathophysiological mechanisms of this association in order to propose a therapy for these patients.
Key words: Cardiovascular autonomic neuropathy, diabetes, orthostatic hypotension, supine hypertension
La neuropathie autonome cardiaque (NAC) est parmi les principales dysautonomies du diabète [1]. Sa prévalence varie de 9% à 91% chez le diabétique type 1 et de 25% à 75% chez les diabétiques type [2]. La NAC se caractérise principalement par l´hypotension orthostatique (HO) et la tachycardie sinusale de repos [3]. L´hypotension orthostatique se définit comme la diminution de la pression artérielle systolique (PAS) d´au moins 20 mmHg, et/ou la pression artérielle diastolique d´au moins 10 mmHg, pendant les 3 premières minutes de l´orthostatisme [4]. Sa prévalence chez les diabétiques est estimée de 6% à 32% [5]. L´association de l´hypotension orthostatique (HO) et de l´hypertension (HTA) du décubitus dorsal (DD) est une des formes dysautonomiques les plus importantes [6] qui peut se voir chez les diabétiques atteints de la neuropathie autonome cardiaque. L´objectif de notre travail est d'essayer de comprendre, en illustrant par un cas clinique, les mécanismes physiopathologiques de cette association afin de proposer une prise en charge thérapeutique pour ces patients.
Il s´agit d´un patient âgé de 65 ans ayant comme facteurs de risque cardiovasculaires; un diabète type II depuis 19 ans sous insuline déséquilibrée compliquée de rétinopathie diabétique et de néphropathie diabétique débutante et une HTA sous antagoniste des récepteurs de l´angiotensine II). Il a consulté pour des vertiges survenant depuis 2 semaines en position debout avec des palpitations et des troubles visuels. L´examen clinique retrouve une TA de 140/80mmg au niveau du bras droit et 150/70mmHg au niveau du bras gauche, la fréquence cardiaque (FC) est 60bat/min. L´examen cardiovasculaire est sans particularités. L´électrocardiogramme inscrit un rythme régulier sinusal à 60cycles/min, l´espace PR est normal à 160 ms. Un complément échocardiographique est revenu sans anomalies. Le bilan biologique est normal. Par la suite, le patient a fait l´objet de l´exploration du système nerveux autonome par le biais des tests de réactivité cardiovasculaire (tests d´Ewing). Ce sont des tests pratiqués à jeun, après arrêt de toute médication pendant au moins 48h. Le patient est d´abord placé dans une ambiance calme en décubitus dorsal sur une table d´inclinaison. Les différents tests sont réalisés en étant entrecoupés de périodes de repos avec une mesure parallèle de la fréquence cardiaque (FC) et la pression artérielle (PA).
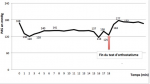
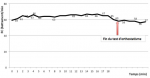
Par ordre de déroulement, il s´agit du test de la respiration profonde ou Deep Breathing (DB), du test de contraction isométrique ou Hand-Grip (HG), du test de Stress mental (SM) ou echo de stress et du test d´orthostatisme. La réponse autonomique cardiovasculaire obtenue pendant les tests est projetée sur le Tableau 1. On note, de ce fait, une déficience vagale associée à une déficience sympathique centrale (α et β) et périphérique (α et β). Le déroulement du test orthostatique est projeté sur les Figure 1, Figure 2. La Figure 1 représente l´évolution des chiffres tensionnels (PAS) pendant le test orthostatique ainsi qu´après passage en décubitus dorsal. D´autre part, la Figure 2, représente l´évolution de la fréquence cardiaque (FC) dans ces mêmes conditions. Au cours du test d´orthostatisme, on note une hypotension orthostatique (passage de la PAS de 169 mmHg à 128mmhg au bout de 3minutes d´orthostatisme). En primo orthostatisme, la fréquence cardiaque est passée de 59 et 65c/min (faible élévation de la FC) puis est restée aux alentours de 65 à 67c/min. Après le test d´orthostatisme et en décubitus dorsal, la PAS est passée 163mmHg à 177mmHg (HTA de décubitus dorsal) et la Fc est restée aux alentours de 56 et 59c/min.
Caractéristiques de la NAC : la tachycardie sinusale de DD et l´HO
La tachycardie sinusale de repos et la perte de variabilité de la fréquence cardiaque sont des signes précoces de la neuropathie autonome cardiaque. Prashanth et al., a démontré l´augmentation significative de la fréquence cardiaque de repos chez les diabétiques par rapport aux sujets normaux [7]. Ceci est lié à la déficience du système parasympathique. Cependant, la particularité de notre patient est sa fréquence cardiaque ralentie à l´état de base aux alentours de 60c/min. Ceci s´explique par la défaillance du système béta-sympathique. L´hypotension orthostatique est un signe tardif de la NAC et témoins de sa sévérité [8]. La présence de symptômes d´intolérance orthostatique signe un mauvais pronostique et un haut niveau de mortalité chez ces patients. Dans la neuropathie autonome cardiaque, l´hypotension orthostatique est due soit à la déficience de la fonction des barorécepteurs soit à la diminution de la sécrétion et/ou la suppression de la réponse des catécholamines par atteinte des fibres sympathiques [4]. D´autre part, l´association de l´HTA et le diabète a un impact majeur dans l´altération de la fonction autonome cardiaque et contribue à l´apparition de l´HO chez les diabétiques. Cela était prouvé dans pas mal d´écrit [9]. Dans son étude, El Bekkali et al. [10] a retrouvé le même constat avec une prévalence de 42,3% chez les diabétiques hypertendus versus 13,6% chez les diabétiques normotendus. Les traitements antihypertenseurs, notamment les vasodilatateurs, aggravent davantage l'hypotension orthostatique chez les diabétiques hypertendus. Notre patient présente une HO neurogène sévère qui s´est manifestée précocement au cours du test. À notre avis, il s´agit d´une HO issue de plusieurs mécanismes. La déficience de l´alpha sympathique périphérique qui est responsable de la vasoconstriction artérielle contribue à la diminution des résistances périphériques et l´apparition de HO orthostatique chez notre patient. On pense également que l´HO pourrait s´expliquer par le retard de l´activation du système rénine angiotensine aldostérone (SRAA) stimulé par le système nerveux alpha sympathique par le biais de la noradrénaline. À la 4e minute du test orthostatique, la PAS est passée de 141 mmHg (14e minute d´orthostatisme) à 116 mmHg (16e minute) puis est rapidement passé à 138mmg de PAS. Ce fait témoigne de la présence d´une anomalie associée des barorécepteurs.
L´HTA du décubitus dorsal
Après le test orthostatisme, une HTA du décubitus dorsal apparait avec des valeurs allant jusqu´à 177/77mmHg. Elle se définit comme l´augmentation de la TA au delà de 150/90 mmHg [11]. Approximativement, 50% des patients avec hypotension orthostatique neurogène font une HTA du décubitus dorsal [12]. D´après Aamar Ahmed et al. elle peut résulter d´une dysfonction des barorécepteurs, d´une augmentation de la volémie lors du passage de la position debout à la position couchée, d´une natriurèse inapropriée ou par le biais de l´augmentation des résistances artérielles (une activité sympathique résiduelle) secondaire à une hypersensibilité des récepteurs adrénégiques post-synaptiques [13]. Masuo et al. [14] a montré que le taux de noradrénaline plasmatique au repos est plus élevé chez les hypertendus ayant une hypotension orthostatique et devient faible lors du passage en position debout et ce, indépendamment du traitement antihypertenseur. Dans des études transversales portant sur des patients ayant l´insuffisance autonomique, il s´est avéré que l´HTA du décubitus dorsal est liée à l´atteinte rénale et à l´hypertrophie ventriculaire gauche [15]. Chez notre patient, on pense que l´activation du SRAA est retardée et ne se manifeste qu´en position couchée. Ce fait entraine l´augmentation de la volémie par stimulation de l´aldostérone et l´apparition d´une HTA de DD. Celle-ci pourrait être également expliquée par l'augmentation de la noradrénaline plasmatique secondaire à l'activation de la glande surrénale.
La prise en charge de l´HO et l´HTA du décubitus dorsal
Comme c´est le cas de notre patient, l´HO peut coexister avec l´HTA de décubitus dorsal. C´est une forme de dysautonomies dont la prise en charge thérapeutique est complexe car le traitement d´une entité peut aggraver l´autre. La prise en charge de l´HO consiste sur les mesures hygiéno-diététiques (bonne réhydratation, éviction du passage brusque en orthostatisme), contention veineuse périphérique, l´apport sodé peut être envisagé mais risque d´aggraver l´HTA de décubitus dorsal. L´éviction des diurétiques et des antihypertenseurs de longue durée d´action s´impose [16]. La midodrine est un agoniste périphérique et sélectif des récepteurs alpha adrénergique qui agit en augmentant les résistances artérielles et le retour veineux à la dose de 2,5mg à 10mg sur 3prises [11]. Chez les patients ayant une HTA de DD sévère (PAS>180mmhg ou PAD>110mmhg), on leur conseille de relever la tête du lit de quelques centimètres le soir si nécessaire de 10 à 20 degrés [12]. Un traitement antihypertenseur de courte durée d´action est à envisager la nuit afin d´éviter l´aggravation de l´HO pendant la journée [13]. L´usage des dérivés nitrés par vois transdermique est le traitement de choix de l´HTA de DD [11]. Il est préconisé de le mettre à l´heure de coucher et de l´enlever une à deux heures avant de se lever [16]. L´objectif tensionnel en décubitus dorsal doit être ≤ 180/110mmHg [17]. Chez les patients qui présentent une PAS entre 160-180mmhg ou PAD entre 90-100mmhg, le traitement doit être individualisé selon le profil de chaque patient [16]. Chez notre patient, nous avons préconisé les mesures hyginodiététiques pour traiter l'hypotension orthostatique. Nous avons opté pour un antihypertenseur de courte durée d'action afin de traiter l'HTA de décubitus dorsal sans aggraver l'HO.
La neuropathie autonome cardiaque chez les diabétiques est souvent latente mais grave. L´apparition des symptômes témoigne d´un stade sévère de la malade d´où l´intérêt de son dépistage à l´aide des tests de réactivité cardiovasculaire. Son traitement est principalement préventif en assurant une bonne hygiène de vie, un control glycémique et la lutte contre les facteurs de risque cardiovasculaires. L´association de l´HO et l´HTA de décubitus dorsal chez les diabétiques atteint de la neuropathie autonome cardiaque pose un problème thérapeutique. Il est nécessaire d´envisager la bonne médication, assurer un suivi régulier pour optimiser les bénéfices du traitement et améliorer la qualité de vie de ces patients.
Les auteurs ne déclarent aucun conflit d´intérêts.
Tous les auteurs ont lu et approuvé la version finale du manuscrit.
Tableau
1: réponse autonomique cardiovasculaire obtenue pendant les
tests
Figure 1: évolution des chiffres de la pression artérielle systolique (PAS) au cours du test d'orthostatisme et après passage en décubitus dorsal
Figure 2 : évolution
de la fréquence cardiaque (FC) au cours du test d'orthostatisme et après
passage en décubitus dorsal
- Anca Motataianu, Smaranda Maier, Zoltan Bajko, Septimiu Voidazan, Rodica Balasa, Adina Stoian. Cardiac autonomic neuropathy in type 1 and type 2 diabetes patients. BMC Neurology. 2018;18(1):126. PubMed | Google Scholar
- Dimitropoulos G, Tahrani AA, Stevens MJ. Cardiac autonomic neuropathy in patients with diabetes mellitus. World J Diabetes. 2014;5(1):17-39. PubMed | Google Scholar
- Valensi P. La neuropathie autonome diabétique: quels sont les risques. Diabetes and Metabolism. 1998;24(3):1783-1786. PubMed | Google Scholar
- Freeman R, Wieling W, Axelrod FB. Consensus statement on the definition of orthostatic hypotension, neurally mediated syncope and the postural tachycardia syndrome. Clin Auton Res. 2011;21(2):69-72. PubMed | Google Scholar
- Shruti Agashe, Steven Petak JD. Cardiac Autonomic neuropathy in diabetes mellitus. Methodist Debakey Cardiovasc J. 2018;14(4):251-256. PubMed | Google Scholar
- Viviana Aursulesei, Angela-Maria Moloce, Petris AO, Irina-Iuliana Costache. Supine hypertension and orthostatic hypotension: A Management Challenge. The Medical-Surgical Journal. 2018;22(3):489-494. Google Scholar
- Prashanth Narayan Dixit, Vijaynath Itagi, Raghavendra Babu YP, Prakash SB. Effect of diabetes mellitus on resting heart rate, postural blood pressure, Valsalva ratio, and blood pressure response to hand grip test. 2018;8(10): 1441-1445. Google Scholar
- Balcoglu AS, Müderrisoglu H. Diabetes and cardiac autonomic neuropathy: clinical manifestations, cardiovascular consequences, diagnosis and treatment. World J Diabetes. 2015 Feb 15; 6(1): 80-91. PubMed | Google Scholar
- Shafiq ur Rahman, Rashid Ahmad, Aamir AH. Prevalence of orthostatic hypotension among diabetic patients in a community hospital of Peshawar. Pak J Physiol. 2010;6(2):37-39. Google Scholar
- El Bakkali M, Benjelloun H, Rkain H, C oghlan L, Radjab Y, Errguig et al. A cross-sectional study evaluating orthostatic hypotension in normotensive and hypertensive patients with diabetes mellitus. JCvD. 2013;1(1):3-7.
- Maxime Lamarre-Cliche. Orthostatic hypotension and supine hypertension in the patient with autonomic failure. Can Journal GenIntern Med. 2014;9(3):91-95. Google Scholar
- Shibao C, Lipsitz LA, Biaggioni I. Evaluation and treatment of orthostatic hypotension. J Am Soc Hypertens. 2013;7(4):317-324. PubMed | Google Scholar
- Aamir Ahmad, Blair Grubb, Liaqat Zaman, Khalil Kanjwal. Syndrome of supine hypertension with orthostatic hypotension: a nightmare for physicians. The Journal of Innovations in Cardiac Rhythm Management. March 2016;7:1-4.
- Kazuko Masuo, Hiroshi Mikami, Toshio Ogihara, Michd Tuck L. Changes in frequency of orthostatic hypotension in elderly hypertensive patients under medications. AJH. 1996;9(3):263-268. PubMed | Google Scholar
- Emily M Garland, Alfredo Gamboa, David Robertson. The Renal Impairment of Pure Autonomic Failure. Hypertension. November 2009; 54(5):1057-1061. PubMed | Google Scholar
- Christopher H Gibbons, Peter Schmidt, Italo Biaggioni, Camille Frazier-Mills, Roy Freeman, Stuart Isaacson. The recommendations of a consensus panel for the screening, diagnosis, and treatment of neurogenic orthostatic hypotension and associated supine hypertension. J Neurol. 2017;264(8):1567-1582. PubMed | Google Scholar
- Phillip A Low, Wolfgang Singer. Management of neurogenic orthostatic hypotension: an update. Lancet Neurol. 2008;7(5): 451-458. PubMed | Google Scholar