Trouble de rythme révélant une sarcoïdose cardiaque et médiastino-pulmonaire : à propos d´un cas
Hajar Arfaoui, Asmaa Fahmi, Souhail Raftani, Hasna Jabri, Wiam Elkhattabi, Moulay Hicham Afif
Corresponding author: Hajar Arfaoui, Service de Pneumologie, Hôpital 20 Août, Casablanca, Maroc 
Received: 18 Jan 2021 - Accepted: 08 Feb 2021 - Published: 16 Feb 2021
Domain: Pulmonology
Keywords: Sarcoïdose, poumon, médiastin, trouble de rythme, cœur, case report
©Hajar Arfaoui et al. PAMJ Clinical Medicine (ISSN: 2707-2797). This is an Open Access article distributed under the terms of the Creative Commons Attribution International 4.0 License (https://creativecommons.org/licenses/by/4.0/), which permits unrestricted use, distribution, and reproduction in any medium, provided the original work is properly cited.
Cite this article: Hajar Arfaoui et al. Trouble de rythme révélant une sarcoïdose cardiaque et médiastino-pulmonaire : à propos d´un cas. PAMJ Clinical Medicine. 2021;5:60. [doi: 10.11604/pamj-cm.2021.5.60.27935]
Available online at: https://www.clinical-medicine.panafrican-med-journal.com//content/article/5/60/full
Case report 
Trouble de rythme révélant une sarcoïdose cardiaque et médiastino-pulmonaire : à propos d´un cas
Trouble de rythme révélant une sarcoïdose cardiaque et médiastino-pulmonaire : à propos d'un cas
Rhythm disorder revealing cardiac and mediastino-pulmonary sarcoidosis: case report
Hajar Arfaoui1,&, Asmaa Fahmi1, ![]() Souhail Raftani1, Hasna Jabri1, Wiam Elkhattabi1, Moulay Hicham Afif1
Souhail Raftani1, Hasna Jabri1, Wiam Elkhattabi1, Moulay Hicham Afif1
&Auteur correspondant
La sarcoïdose peut toucher plusieurs organes dans des formes systémiques. Les auteurs rapportent le cas d´une patiente admise pour une dyspnée à l´effort et des polyarthralgies diffuses avec un antécédent de trouble de rythme évoluant depuis 2 ans. Le bilan a confirmé une sarcoïdose médiatino-pulmonaire révélée à posteriori par l´atteinte cardiaque.
Systemic sarcoidosis can affect several organs. We here report the case of a female patient admitted with breathlessness on exertion and diffuse polyarthralgia as well as a history of rhythm disorder evolving over the past 2 years. Patient´s assessment confirmed mediastino-pulmonary sarcoidosis, which was subsequently revealed by cardiac disease.
Key words: Sarcoidosis, lung, mediastinum, rhythm disorder, heart
La sarcoïdose peut se limiter à une atteinte unique, pulmonaire par exemple, ou toucher plusieurs organes dans les formes systémiques. Les atteintes cardiaques des sarcoïdoses sont des localisations graves qui doivent être reconnues [1]. Nous rapportons le cas d´une patiente pour laquelle le trouble de rythme a permis d´établir le diagnostic de la sarcoïdose cardiaque (SC) et médiastino-pulmonaire.
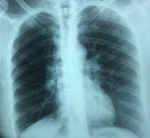
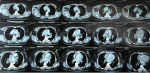
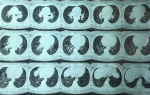
Madame K.G âgée de 42 ans, venait en consultation en pneumologie pour une dyspnée à l´effort associée à des polyarthralgies diffuses. Parmi ses antécédents figurait un trouble de rythme sous béta-bloquant depuis 2 ans. À l´examen, on retrouvait un rythme cardiaque irrégulier associé à des lésions violacées au niveau des deux membres inférieurs et au niveau des 2 olécranes correspondant à un érythème noueux. Le reste de l´examen clinique était sans particularité. La radiographie thoracique a objectivé des opacités à projection hilaire bilatérale avec une opacité à projection latéro-trachéale droite associées à des infiltrats hilo-basaux (Figure 1). La tomodensitométrie (TDM) thoracique a montré des polyadénopathies médiatinales associées à quelques épaississements péribroncho-vasculaires et un verre dépoli déclive (Figure 2, Figure 3). La bronchoscopie souple a trouvé une inflammation de 1er degré diffuse, les biopsies bronchiques étagées révélaient une inflammation granulomateuse tuberculoïde non nécrosante. Les examens biologiques étaient normaux en particulier le bilan hépatique, rénal, phosphocalcique urinaire et sanguin. Le taux de l´enzyme de conversion était normal. L´échographie abdomino-pelvienne, l´électrocardiogramme, l´échocœur, les examens ophtalmologiques et oto-rhino-laryngologiques (ORL) étaient sans particularité. La biopsie des glandes salivaires accessoires montrait une scialadénite grade 1 de Chisholm et Mason. L´exploration fonctionnelle respiratoire (EFR) était sans particularité.
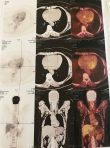
L´électrocardiogramme a objectivé un rythme cardiaque sinusal irrégulier, ainsi une sarcoïdose cardiaque a été suspectée. La tomographie par émission de positons (TEP-TDM) a montré un myocarde de captation hétérogène avec individualisation de 2 foyers métaboliques au niveau de la paroi latérale du ventricule gauches (VG) et au niveau du septum. L´aspect est compatible avec une localisation cardiaque, présence de micronodules faiblement métaboliques diffus aux 2 champs pulmonaires et absence de captation ganglionnaire qui soit en faveur d´atteinte active (Figure 4). Après confrontation anatomoclinique, le diagnostic retenu était celui de la sarcoïdose thoracique y compris cardiaque devant une granulomatose épithélioïde et gigantocellulaire au niveau des biopsies bronchiques et la captation à la TEP-TDM. Notre patiente a été mise sous corticothérapie générale (prednisone 0,5mg/kg) avec dégression toutes les 6 semaines, devant l´atteinte cardiaque, avec bonne évolution clinique et életrocardiographique sur 6 mois. Elle est toujours sous traitement.
La sarcoïdose est une maladie systémique de cause inconnue caractérisée par la présence de granulomes épithélioïdes et gigantocellulaires sans nécrose caséeuse [2]. Elle affecte principalement le poumon et les ganglions lymphatiques. L´atteinte cardiaque correspond à une infiltration hétérogène du myocarde par les granulomes conduisant à la fibrose myocardique. Elle peut être asymptomatique ou donner une insuffisance cardiaque sévère en passant par des troubles du rythme et de conduction ou une mort subite. Les trois enveloppes cardiaques peuvent être touchées, mais c´est essentiellement le myocarde qui est atteint et les lésions prédominent au niveau de la base du septum interventriculaire, du système de conduction et de la paroi libre du ventricule gauche [3, 4]. L´atteinte cardiaque correspond à la deuxième cause de mortalité due à la sarcoïdose dans les pays occidentaux [5]. Les signes cliniques, électriques ou échocardiographiques ne sont pas proportionnels au degré d´infiltration mais dépendent de la localisation des granulomes et de la formation éventuelle de cicatrices fibreuses [6].
En pratique, il existe des critères diagnostiques d´une atteinte cardiaque de la sarcoïdose publiés par les japonais qui définissent les sarcoïdoses cardiaques histologiquement établies (lorsqu´une biopsie endomyocardique montre du granulome sans nécrose) et les sarcoïdoses cardiaques cliniquement établies grâce à des critères majeurs et mineurs d´atteinte cardiaque en présence d´une sarcoïdose extracardiaque prouvée histologiquement. Le “World Association of Sarcoidosis and Other Granulomatous Disorders (WASOG)” a également publié, à partir d´une enquête Delphi, la définition d´une atteinte cardiaque hautement probable (> 90%), probable (50-90%) et possible (< 50%) [7]. Enfin, un consensus international d´experts a proposé de dépister une atteinte cardiaque au cours d´une sarcoïdose par la recherche de signes cliniques, un électrocardiogramme 12 dérivations et une échocardiographie [8]. À côté de ces critères, deux examens se sont développés récemment dans le diagnostic et le suivi de la SC : l´imagerie par résonance magnétique cardiaque (IRMc) et la tomoscintigraphie par émission de positons fluorodéoxyglucose (TEP-FDG). Sur l´IRMc, le signe le plus spécifique est le rehaussement tardif après injection de gadolinium, de localisation sous-épicardique ou intra-murale. Néanmoins, il ne permet pas de distinguer les lésions actives des lésions fibrosantes séquellaires. Par contre, tomographie par émission de positons au 18 fluoro-désoxyglucose (TEP-FDG), réalisée après un régime adapté, a une bonne sensibilité pour détecter les lésions granulomateuses inflammatoires [9]. La présence d´une anomalie IRM ou au 18FDG-TEP scanner constitue un facteur pronostique défavorable au sein des sarcoïdoses [10-13].
Le traitement des atteintes cardiaques de la sarcoïdose comporte, d´une part, l´immunosuppression et, d´autre part, la prise en charge de l´insuffisance cardiaque ou des troubles du rythme. L´objectif de l´immunosuppression est de supprimer les lésions granulomateuses actives mais également d´empêcher l´évolution vers des cicatrices fibreuses. La dose et la durée de la corticothérapie ne sont pas consensuelles. Une posologie de 1 mg/kg/j est généralement prescrite [14, 15]. Même si ce point reste discuté, la majorité des auteurs s´accordent pour un traitement pendant au minimum 24 mois [16]. Dans les atteintes cardiaques réfractaires au cours de la sarcoïdose, l´infliximab a pu être utilisé avec succès [17, 18].
En conclusion, la sarcoïdose cardiaque est une localisation grave qui doit être reconnue. Le dépistage d´une atteinte cardiaque en présence d´une sarcoïdose extracardiaque passe par l´interrogatoire et l´examen physique, un électrocardiogramme 12 dérivations et une échocardiographie cardiaque. L´IRM et le 18FDG-TEP scanner ont permis d´améliorer leur détection par rapport aux seuls signes cliniques, électriques ou échocardiographiques et constituent un élément pronostique.
Les auteurs ne déclarent aucun conflit d´intérêts.
Tous les auteurs ont contribué à ce travail. Ils ont lu et approuvé la version finale du manuscrit.
Figure 1 : radiographie thoracique : aspect de lymphome hilaire bilatéral
Figure 2 : TDM thoracique montant des polyadénopathies médiatinales
Figure 3 : TDM thoracique montant quelques épaississements péribroncho-vasculaires et un verre dépoli déclive
Figure 4 : TEP-TDM : myocarde
de captation hétérogène avec individualisation de 2 foyers
métaboliques au niveau de la paroi latérale du VG et au niveau
du septum, aspect compatible avec une localisation cardiaque
- Cohen Aubart F, Nunes H, Mathian A, Haroche J, Hié M, Le-Thi Huong Boutin D et al. Sarcoïdose cardiaque : avancées diagnostiques et thérapeutiques. La Revue de Médecine Interne. 2017;38(1):28-35. PubMed | Google Scholar
- Statement on sarcoidosis. Joint Statement of the American Thoracic Society (ATS), the European Respiratory Society (ERS) and the World Association of Sarcoidosis and Other Granulomatous Disorders (WASOG) adopted by the ATS Board of Directors and by the ERS Executive Committee, February 1999. Am J Respir Crit Care Med. 1999;160(2):736-755. PubMed
- Roberts WC, McAllister HA, Ferrans VJ. Sarcoidosis of the heart. A clinicopathologic study of 35 necropsy patients (group 1) and review of 78 previously described necropsy patients (group 11). Am J Med. 1977;63(1):86-108. PubMed | Google Scholar
- Matsui Y, Iwai K, Tachibana T, Fruie T, Shigematsu N, Izumi T et al. Clinicopathological study of fatal myocardial sarcoidosis. Ann N Y Acad Sci. 1976;278:455-469. PubMed | Google Scholar
- Swigris JJ, Olson AL, Huie TJ, Fernandez-Perez ER, Solomon J, Sprunger D et al. Sarcoidosis-related mortality in the United States from 1988 to 2007. Am J Respir Crit Care Med. 2011;183(11):1524-1530. PubMed | Google Scholar
- Aubart F, Diebold B, Dhote R, Weinmann P, Valeyre D. Cardiac sarcoidosis. Rev Mal Respir. 2003;20(6 Pt 3):S45-49. PubMed
- Judson MA, Costabel U, Drent M, Wells A, Maier L, Koth L et al. The WASOG Sarcoidosis Organ Assessment Instrument: An update of a previous clinical tool. Sarcoidosis VDLD. 2014;31(1):19-27. PubMed | Google Scholar
- Birnie DH, Sauer WH, Bogun F, Cooper JM, Culver DA, Duvernoy CS et al. HRS expert consensus statement on the diagnosis and management of arrhythmias associated with cardiac sarcoidosis. Heart Rhythm. 2014;11(7):1305-1323. PubMed | Google Scholar
- Goyard C, Benattia A. Caractéristiques cliniques, cardiologiques et pronostiques des patients atteints de sarcoïdose cardiaque. Étude de cas-témoins. Revue des Maladies Respiratoires Actualités. 2015;7(2):158-160. Google Scholar
- Blankstein R, Osborne M, Naya M, Waller A, Kim CK, Murthy VL et al. Cardiac positron emission tomography enhances prognostic assessments of patients with suspected cardiac sarcoidosis. J Am Coll Cardiol. 2014;63(4):329-336. PubMed | Google Scholar
- Greulich S, Deluigi CC, Gloekler S, Wahl A, Zürn C, Kramer U et al. CMR imaging predicts death and other adverse events in suspected cardiac sarcoidosis. JACC Cardiovasc Imaging. 2013;6(4):501-511. PubMed | Google Scholar
- Patel MR, Cawley PJ, Heitner JF, Klem I, Parker MA, Jaroudi WA et al. Detection of myocardial damage in patients with sarcoidosis. Circulation. 2009;120(20):1969-1977. PubMed | Google Scholar
- Isiguzo M, Brunken R, Tchou P, Xu M, Culver DA. Metabolism-perfusion imaging to predict disease activity in cardiac sarcoidosis. Sarcoidosis Vasc Diffuse Lung Dis. 2011;28(1):50-55. PubMed | Google Scholar
- Yazaki Y, Isobe M, Hiroe M, Morimoto S, Hiramitsu S, Nakano T et al. Prognostic determinants of long-term survival in Japanese patients with cardiac sarcoidosis treated with prednisone. Am J Cardiol. 2001;88(9):1006-1010. PubMed | Google Scholar
- Kandolin R, Lehtonen J, Kupari M. Cardiac sarcoidosis and giant cell myocarditis as causes of atrioventricular block in young and middle-aged adults. Circ Arrhythm Electrophysiol. 2011;4(3):303-309. PubMed | Google Scholar
- Lynch JP, Hwang J, Bradfield J, Fishbein M, Shivkumar K, Tung R. Cardiac involvement in sarcoidosis: evolving concepts in diagnosis and treatment. Semin Respir Crit Care Med. 2014;35(3):372-390. PubMed | Google Scholar
- Uthman I, Touma Z, Khoury M. Cardiac sarcoidosis responding to monotherapy with infliximab. Clin Rheumatol. 2007;26(11):2001-2003. PubMed | Google Scholar
- Barnabe C, McMeekin J, Howarth A, Martin L. Successful treatment of cardiac sarcoidosis with infliximab. J Rheumatol. 2008;35(8):1686-1687. PubMed | Google Scholar