Tumeurs neuroendocrines à cellules claires du pancréas : à propos de deux cas et revue de la littérature
Zouhour Samlani, Yassine Lemfadli, Adil Ait Errami, Sofia Oubaha, Abderrachid Hamdaoui, Khadija Krati
Corresponding author: Yassine Lemfadli, Service de Gastro-Entérologie, Centre Hospitalier Mohamed VI, Marrakech, Maroc 
Received: 17 Jun 2021 - Accepted: 25 Jul 2021 - Published: 18 Aug 2021
Domain: Histopathology,Gastroenterology
Keywords: Tumeur neuroendocrine à cellules claires, pancréas, echoendoscopie-FNB
©Zouhour Samlani et al. PAMJ Clinical Medicine (ISSN: 2707-2797). This is an Open Access article distributed under the terms of the Creative Commons Attribution International 4.0 License (https://creativecommons.org/licenses/by/4.0/), which permits unrestricted use, distribution, and reproduction in any medium, provided the original work is properly cited.
Cite this article: Zouhour Samlani et al. Tumeurs neuroendocrines à cellules claires du pancréas : à propos de deux cas et revue de la littérature. PAMJ Clinical Medicine. 2021;6:40. [doi: 10.11604/pamj-cm.2021.6.40.30402]
Available online at: https://www.clinical-medicine.panafrican-med-journal.com//content/article/6/40/full
Case report 
Tumeurs neuroendocrines à cellules claires du pancréas : à propos de deux cas et revue de la littérature
Tumeurs neuroendocrines à cellules claires du pancréas : à propos de deux cas et revue de la littérature
Clear cell neuroendocrine tumors (NETs) of the pancreas: about two cases and literature review
Zouhour Samlani1, ![]() Yassine Lemfadli1,&, Adil Ait Errami1, Sofia Oubaha2, Abderrachid Hamdaoui3, Khadija Krati1
Yassine Lemfadli1,&, Adil Ait Errami1, Sofia Oubaha2, Abderrachid Hamdaoui3, Khadija Krati1
&Auteur correspondant
Les tumeurs neuroendocrines à cellules claires du pancréas ont été rarement rapportées dans la littérature. Cette entité nosologique rare pose un problème de diagnostic différentiel avec de nombreuses tumeurs primitives et métastatiques du pancréas. Cependant, l´utilisation des techniques de l'immunohistochimie et de l´histologie pourra faciliter le diagnostic. Nous avons colligé deux cas dans notre établissement au cours de la dernière année avec des tumeurs neuroendocrines pancréatiques primitives à cellules claires. Nous présentons leurs cas dans le but de contribuer aux données disponibles sur le sujet. Nous insistons sur l´intérêt de l´échoendoscopie dans le diagnostic positif et nous fournissons également une revue actualisée de la littérature disponible à ce jour concernant les tumeurs neuroendocrines à cellules claires du pancréas.
Clear cell neuroendocrine tumors (NETs) of the pancreas have rarely been reported in the literature. This rare nosological entity poses problems in differential diagnosis of several primitive and metastatic tumors of the pancreas. However, the use of immunohistochemical and histological techniques may facilitate diagnosis. We collected data from the medical records of two patients with primary clear cell neuroendocrine tumors (NETs) of the pancreas in our hospital over the past year The purpose of this study is to contribute to enrich data on this subject. We here emphasize the importance of endoscopic ultrasound (EUS)-guided fine needle biopsy (FNB) in positive diagnosis and also provide an updated literature review on clear cell neuroendocrine tumors (NETs) of the pancreas.
Key words: clear cell neuroendocrine tumors, pancreas, endoscopic ultrasound-FNB
Les tumeurs neuroendocrines pancréatiques (TNEP) ne représentent que 1 à 2% de toutes les tumeurs pancréatiques [1]. La variante à cellule claire est rare et peut être confondue morphologiquement avec de nombreuses autres tumeurs pancréatiques. L´histologie par biopsie à l'aiguille fine (FNB) obtenue par échoendoscopie est utilisée pour le diagnostic initial des masses pancréatiques avec une sensibilité et une spécificité approchant respectivement 98% et 100% [2-5]. La combinaison de la cytopathologie et de l'immunohistochimie permet le diagnostic de TNEP dans la plupart des cas [6,7]. À notre connaissance, seuls huits rapports de cas de TNEP à cellules claires diagnostiqués par FNB sont publiés [8-12]. Nous rapportons 2 cas de cette entité nosologique rare, diagnostiqués sur biopsie à l'aiguille fine (FNB) par échoendoscopie.
Observation 1
Informations du patient : un homme de 67 ans s'est présenté avec des douleurs abdominales de siège épigastrique, associés à des diarrhées liquidiennes depuis 3 mois avec amaigrissement. Il n´a pas rapporté de fièvre ou d´ictère. Ses antécédents médicaux comprenaient un alcoolisme et un tabagisme chroniques.
Résultats cliniques : l´examen physique était normal, à l'exception de la présence d'une sensibilité abdominale au niveau de la région épigastrique.
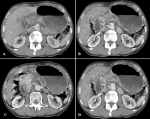
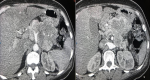
Démarche diagnostique : les investigations biologiques étaient les suivantes: hémoglobine à 12 g/dl, globules blancs à 4760/mm3, plaquettes à 200000/mm3. La glycémie, la calcémie et la fonction hépatique étaient normaux. Le dosage du CA 19-9 était à 1,3 U/ml et l´ACE à 9,7 ng/ml. La chromogranine sérique était à 1175 ng/ mL. La TDM abdominale a montré une lésion pancréatique corporeo- isthmique de 31x20mm spontanément hypodense, discrètement rehaussé après injection de produit de contraste. Il s´y associe une atrophie de la queue du pancréas avec infiltration de la graisse de voisinage. Cette lésion infiltre la lame retro portale et englobe l´artère mésentérique supérieure, le tronc cœliaque ainsi que les segments initiaux de l´artère splénique et hépatique commune. Par ailleurs il y a avaient un nodule du segment II du foie mesurant 13,2 mm d´allure secondaire associé à deux lésions surrénaliennes gauches mesurant respectivement 22x14 mm et 12x10 mm d´allure secondaires avec des kystes rénaux corticaux bilatéraux simples. Il y avait une carcinose péritonéale avec des adénomégalies locorégionaux (Figure 1).
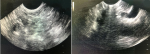
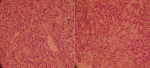
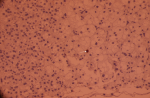
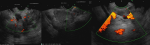
L´échoendoscopie avait montré lésion hypoéchogène au niveau du corps et de l´isthme pancréatique mesurant 3 cm environ au niveau de son grand axe et qui englobent les vaisseaux mésentériques et l´artère splénique (Figure 2). Une biopsie à l´aiguille fine (FNB) (Acquire Boston® 22ga) a été réalisée. L'examen histologique a décrit une prolifération d´architecture trabéculaire et en petits nids, richement vascularisée avec un stroma modérément abondant œdémateux ou fibrohyalin. Les cellules sont polygonales, de taille moyenne à cytoplasme clair ou microvacuolaire spumeux. Les mitoses sont peu nombreuses (3 mitoses par dix champs grossissement x400) sans atypies (Figure 3). L'immunohistochimie (IHC) était négative pour la Chromagranine A, négative pour la synaptophysine, positive pour la pancytokératine (AE1-AE3) et fortement positif pour le CD56 avec un marqueur de prolifération Ki-67 de 2% (Figure 4). Le diagnostic final était une TNE pancréatique à cellules claires de grade 1 bien différenciée classée T2N2M1.
Interventions thérapeutiques et suivi : le patient a été envoyé au service de d´oncologie pour complément de prise en charge.
Observation 2
Informations de la patiente : une femme de 68 ans a été admise à l'hôpital pour des douleurs épigastriques à irradiation dorsale, sans ictère, ni fièvre. Elle n´avait pas d´antécédents médicaux particuliers.
Résultats cliniques : l´examen clinique a objectivé une sensibilité de d´épigastre sans défense ni masse palpable.
Démarche diagnostique : les résultats de laboratoire ont révélé un taux d´hémoglobine à 9,5 g/dl avec VGM à 76 μ 3 et TCMH à 25 pg. La férritinémie était de 250 ng/ml et le bilan hépatique avait objectivé un taux normal des ASAT, ALAT, γGT et PAL. Le taux de bilirubine totale était à 20 mg/l avec une bilirubine directe à 12 mg/l. Le taux de CA19.9 était à 540 UI /ml et l´ACE à 14 mg/ml. La TDM abdominale a montré une masse hétérogène hypodense irrégulière de la tête, du corps et de la queue du pancréas. Cette masse englobe le tronc cœliaque et les vaisseaux spléniques avec une thrombose partielle de la veine splénique (Figure 5).
L´échoendoscopie a montré une masse hypoéchogène hétérogène de la tête, du corps et de la queue du pancréas avec englobement des vaisseaux mésentériques et du tronc cœliaque (Figure 6). Une biopsie à l'aiguille fine par échoendoscopie (EUS-FNB) a été réalisée. Les résultats anatomopathologiques des échantillons ont révélé une tumeur neuroendocrine bien différenciée. L´immunohistochimie (IHC) a révélé l´expression de synaptophysine et chromogranine A avec un KI-67 de 8% et un indice prolifératif moins de 2% (Figure 7). Le diagnostic d´une tumeur neuroendocrine pancréatique sporadique à cellules claires sans syndrome hormonal a été retenu.
Interventions thérapeutiques et suivi : la tumeur a été jugée non résécable et la patiente a été envoyée au service d´oncologie pour complément de prise en charge.
Les TNE du pancréas sont des tumeurs développées au niveau pancréatique avec une différenciation neuroendocrine prédominante. Elles peuvent être fonctionnelles, associées à des symptômes cliniques caractéristiques liés à une hypersécrétion hormonale, ou non fonctionnelles. La variante à cellules claires des TNE du pancréas est rare. Elles peuvent être primitives ou métastatiques [13]. Bien que le pancréas soit un site rare de métastases, le carcinome rénal est le cancer métastatique le plus fréquent du pancréas [14]. Les variantes de TNE décrites dans le pancréas comprennent les types à cellules claires, oncocytaires, pléomorphes et rhabdoïdes [15]. Dans celui des cellules claires, la clarté cytoplasmique est attribuée à l'accumulation de glycogène, de mucine ou de lipides. Il peut également être produit par le gonflement des organites cytoplasmiques [16,17].
Le diagnostic positif des TNE peut être rendu en toute confiance en présence de caractéristiques morphologiques caractéristiques et l'expression immunohistochimique des marqueurs neuroendocrines tels que la chromogranine A et la synaptophysine. En cas de bonne différenciation, les cellules sont de taille moyenne et monomorphes sans atypie cytonucléaire majeure. Les noyaux contiennent une chromatine fine et le stroma est richement vascularisé le plus souvent [18]. Le grade histo-pronostique est déterminé par l´indice mitotique (nombre de mitoses sur 10 champs a fort grossissement et l´index de proliferation Ki67.
La classification de l´Organisation Mondiale de la Santé comporte 5 catégories selon la différenciation et le grade tumoral, qui reposent notamment sur la distinction entre les TNE bien différenciées et les carcinomes neuroendocrines (CNE) peu différenciés (Tableau 1). Les TNEP doivent également être classées selon le stade TNM dont il existe 2 classifications différentes ; la classification UICC/AJCC [19] et celle d´ENETS [20] qui est mieux corrélée au pronostic (Tableau 2).
Les techniques d´imagerie en coupes (scanner et IRM) sont les examens clés pour le diagnostic initial, le bilan d´extension, la recherche de complications et le suivi des TNEP. Les diagnostics différentiels des TNE à cellules claires du pancréas incluent les métastases de carcinome rénal, le carcinome exocrine à cellules claires du pancréas, adénome séreux microkystique (riche en glycogène) et l´adénocarcinome, un nodule corticosurrénalien hyperplasique ectopique et une tumeur pancréatique pseudopapillaire solide [21]. Cependant, l´analyse cytopathologique et immunohistochimique permet de confirmer la nature neuroendocrine des cellules tumorales et d´écarter les autres diagnostiques (Tableau 3).
La résection chirurgicale des TNEP non fonctionnelles symptomatiques localisées reste le traitement de choix. Selon les directives ENETS, ces patients peuvent subir une résection de la tumeur primitive avec résection des métastases hépatiques en absence d´envahissement tumoral important. Une énucléation chirurgicale est une option pour les petites tumeurs < 1 cm et de bas grade. La duodénopancréatectomie céphalique est recommandée pour les TNE de la tête du pancréas alors que la pancréatectomie distale devrait être l'opération de choix pour lésions situées dans le corps et la queue. Un curage ganglionnaire est recommandé pour toute lésion > 2 cm ou en présence de calcifications [22]. Les options thérapeutiques des TNE pancréatiques bien différenciées métastatiques incluent la chirurgie, les analogues de la somatostatine, la chimiothérapie, les thérapies ciblées (sunitinib, évérolimus), la chimio-embolisation intra-artérielle hépatique et la radiothérapie interne vectorisée [23].
Les tumeurs neuroendocrines à cellules claires du pancréas est une variante très inhabituelle. Elle peut être facilement mal diagnostiquée. La combinaison de caractéristiques histologiques et immuno-histochimiques permet de fournir un diagnostic précis, de classer la tumeur, de guider le traitement et de prédire le pronostic.
Les auteurs ne déclarent aucun conflit d'intérêts.
Tous les auteurs ont participé à ce travail. Tous ont lu et approuvé la version finale du manuscript.
Tableau 1 : grade et classification des tumeurs neuroendocrines pancréatiques
Tableau 2 : classification TNM des tumeurs neuroendocrines pancréatiques selon l´ENETS [20] et l´AJCC/UICC [19]
Tableau 3 : principaux diagnostiques différentiels des tumeurs neuroendocrines à cellules claires du pancréas
Figure 1 : (A, B) lésion tumorale du pancréas ; (C, D) lésions surrénaliennes gauche
Figure 2 : image per echoencoscopie montrant une lésion hypoéchogène au niveau du corps et de l´isthme pancréatique
Figure 3 : prolifération tumorale avec des cellules polygonales, à cytoplasme claire et microvacuolaire spumeux avec des mitoses peu nombreuses
Figure 4 : expression de Ki67 de 2% (flèche)
Figure 5 : TDM abdominale montrant une masse pancréatique avec envahissement des du tronc cœliaque et des vaisseaux spléniques
Figure 6 : échoendoscopie de la masse pancréatique avec envahissement du tronc cœliaque
Figure 7 : A) petits nids de cellules tumorales (HE 400); B) expression de la chromogranine (HE 400); C) expression de la synaptophysine (HE 400)
- Asa SL. Pancreatic endocrine tumors. Mod Pathol. 2011;24(Suppl 2):S66-77. PubMed
- Hasan MK, Hawes RH. EUS-guided FNA of solid pancreas tumors. Gastrointest Endosc Clin N Am. 2012 Apr;22(2):155-67, vii. PubMed | Google Scholar
- David O, Green L, Reddy V, Kluskens L, Bitterman P, Attal H et al. Pancreatic masses: a multi-institutional study of 364 fine-needle aspiration biopsies with histopathologic correlation. Diagn Cytopathol. 1998 Dec;19(6):423-7. PubMed | Google Scholar
- Voss M, Hammel P, Molas G, Palazzo L, Dancour A, O'Toole D et al. Value of endoscopic ultrasound guided fine needle aspiration biopsy in the diagnosis of solid pancreatic masses. Gut. 2000 Feb;46(2):244-9. PubMed | Google Scholar
- Jhala NC, Jhala DN, Chhieng DC, Eloubeidi MA, Eltoum IA. Endoscopic ultrasound-guided fine-needle aspiration. A cytopathologist´s perspective. Am J Clin Pathol. 2003 Sep;120(3):351-67. PubMed | Google Scholar
- Chang F, Vu C, Chandra A, Meenan J, Herbert A. Endoscopic ultrasound-guided fine needle aspiration cytology of pancreatic neuroendocrine tumours: cytomorphological and immunocytochemical evaluation. Cytopathology. 2006 Feb;17(1):10-7. PubMed
- Kim L, Liao J, Zhang M, Talamonti M, Bentrem D, Rao S et al. Clear cell carcinoma of the pancreas: histopathologic features and a unique biomarker: Hepatocyte nuclear factor-1β. Mod Pathol. 2008;21:1075-83. Google Scholar
- Safo AO, Li RW, Vickers SM, Schmechel SC, Pambuccian SE. Endoscopic ultrasound-guided fine-needle aspiration diagnosis of clear-cell pancreatic endocrine neoplasm in a patient with von Hippel-Lindau disease: a case report. Diagn Cytopathol. 2009 May;37(5):365-72. PubMed | Google Scholar
- Chen S, Wu HH, Cramer H. Fine needle aspiration cytology of a clear cell (lipid-rich) pancreatic neuroendocrine tumour in a patient without von Hippel-Lindau disease. Cytopathology. 2013 Jun;24(3):197-8. PubMed | Google Scholar
- Ayub SB, Dodge J. Lipid-rich variant of pancreatic endocrine neoplasms: A case report. Acta Cytol. 2010;54(Suppl):829-34. PubMed | Google Scholar
- Levy GH, Finkelstein A, Harigopal M, Chhieng D, Cai G. Cytoplasmic vacuolization: An under-recognized cytomorphologic feature in endocrine tumors of the pancreas. Diagn Cytopathol. 2013 Jul;41(7):623-8. PubMed | Google Scholar
- Gagandeep Kaur, Pooja Bakshi, Vikas Singla, Kusum Verma. Clear cell neuroendocrine tumor of pancreas: Endoscopic Ultrasound-guided fine needle aspiration diagnosis of an uncommon variant. CytoJournal. 2016 Mar 18;13:7. PubMed | Google Scholar
- Kim L, Liao J, Zhang M, Talamonti M, Bentrem D, Rao S. Clear cell carcinoma of the pancreas: histopathologic features and a unique biomarker: hepatocyte nuclear factor-1beta. Mod Pathol. 2008 Sep;21(9):1075-83. PubMed | Google Scholar
- Konstantinidis IT, Dursun A, Zheng H, Wargo JA, Thayer SP, Fernandez-del Castillo C et al. Metastatic tumors in the pancreas in the modern era. J Am Coll Surg. 2010 Dec;211(6):749-53. PubMed | Google Scholar
- Kasajima A, Yazdani S, Sasano H. Pathology diagnosis of pancreatic neuroendocrine tumors. J Hepatobiliary Pancreat Sci. 2015 Aug;22(8):586-93. PubMed | Google Scholar
- Ordóñez NG, Silva EG. Islet cell tumour with vacuolated lipid-rich cytoplasm: a new histological variant of islet cell tumour. Histopathology. 1997;31(2):157-60. Google Scholar
- Guarda LA, Silva EG, Ordóñez NG, Mackay B, Ibanez ML. Clear cell islet cell tumor. Am J Clin Pathol. 1983 Apr;79(4):512-7. PubMed
- Scoazec JY, Couvelard A, pour Le Reseau Tenpath. Gastroenteropancreatic neuroendocrine tumors: what must the pathologist know and do in 2014?. Ann Pathol. 2014 Feb;34(1):40-50. PubMed | Google Scholar
- Sobin LH, Gospodarowicz MK, Wittekind C. International Union against Cancer. TNM classification of malignant tumours. 7th ed. 2009. Chichester, West Sussex, UK ; Hoboken, NJ: Wiley-Blackwell; 2010.
- Rindi G, Klöppel G, Alhman H, Caplin M, Couvelard A, de Herder WW et al. TNM staging of foregut (neuro)endocrine tumors: a consensus proposal including a grading system. Virchows Arch. 2006 Oct;449(4):395-401. PubMed | Google Scholar
- Nunobe S, Fukushima N, Yachida S, Shimada K, Kosuge T, Sakamoto M. Clear cell endocrine tumor of the pancreas which is not associated with von Hippel-Lindau disease: report of a case. Surg Today 2003;33:470-474. Google Scholar
- Falconi M, Eriksson B, Kaltsas G, Bartsch DK, Capdevila J, Caplin M et al. Consensus guidelines update for the management of functional p-NETs (F-p-NETs) and non functional p-NETs (NF-p-NETs). Neuroendocrinology. 2016;103(2):153-71. Google Scholar
- Philippe Ruszniewski. Tumeurs neuroendocrines pancréatiques. POST´U. 2019.